Test rapide du bal
Utilisation prévue
Le fort®Le test du PROM est un test immunochromatographique qualitatif visuellement interprété pour la détection de l'IGFBP-1 à partir du liquide amniotique dans les sécrétions vaginales pendant la grossesse. Le test est destiné à une utilisation professionnelle pour aider à diagnostiquer la rupture des membranes fœtales (ROM) chez les femmes enceintes.
INTRODUCTION
La concentration d'IGFBP-1 (protéine de liaison au facteur de croissance de type insuline) dans le liquide amniotique est de 100 à 1000 fois plus élevée que dans le sérum maternel. L'IGFBP-1 n'est généralement pas présent dans le vagin, mais après rupture des membranes fœtales, le liquide amniotique avec une concentration élevée d'IGFBP-1 se mélange avec des sécrétions vaginales. Dans le test de PROM Strongstep®, un échantillon de sécrétion vaginale est pris avec un casse-tête en polyester stérile et l'échantillon est extrait dans une solution d'extraction d'échantillons. La présence d'IGFBP-1 dans la solution est détectée à l'aide d'un dispositif de test rapide.
PRINCIPE
Le fort®Le test de PROH utilise la technologie immunochromatographique des couleurs et le flux capillaire. La procédure d'essai nécessite la solubilisation de l'IGFBP-1 à partir d'un écouvillon vaginal en mélangeant l'écouvillon dans un tampon d'échantillon. Ensuite, le tampon d'échantillonnage mixte est ajouté à l'échantillon de cassette de test bien et le mélange migre le long de la surface de la membrane. Si l'IGFBP-1 est présent dans l'échantillon, il formera un complexe avec l'anticorps anti-IGFBP-1 primaire conjugué à des particules colorées. Le complexe sera alors lié par un deuxième anticorps anti-IGFBP-1 enduit sur la membrane de nitrocellulose. L'apparition d'une ligne de test visible avec la ligne de contrôle indiquera un résultat positif.
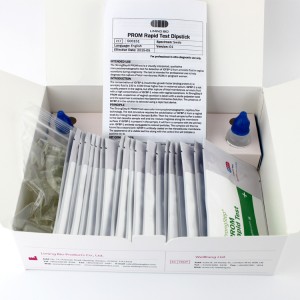
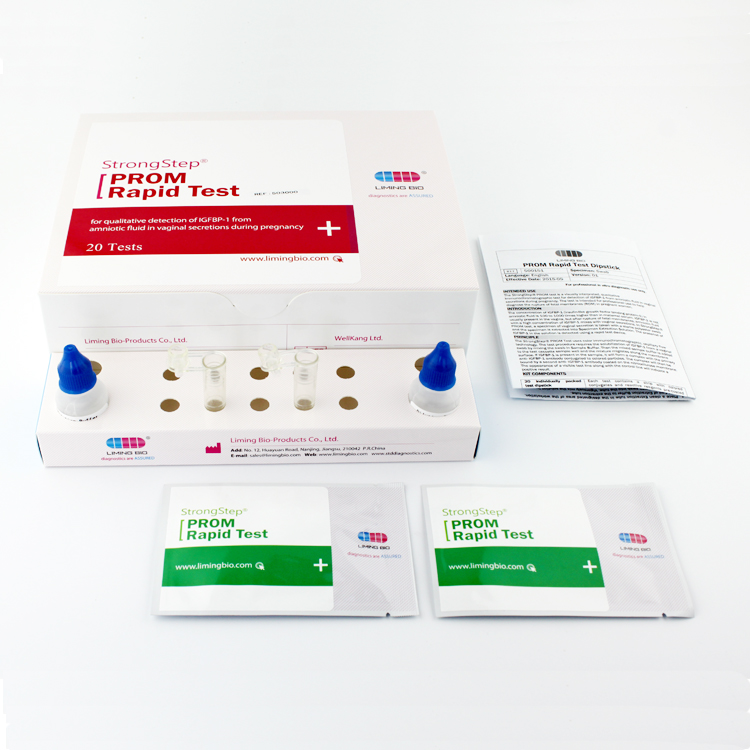
Composants du kit
| 20 Individuellement packdispositifs de test ED | Chaque dispositif contient une bande avec des conjugués colorés et des réactifs réactifs précoés dans les régions correspondantes. |
| 2ExtractionFlacon de tampon | Saline tamponnée au phosphate 0,1 M (PBS) et 0,02% d'azide de sodium. |
| 1 écouvillon de contrôle positif (sur demande uniquement) | Contiennent de l'IGFBP-1 et de l'azide de sodium. Pour le contrôle externe. |
| 1 écouvillon de contrôle négatif (sur demande uniquement) | Ne contiennent pas IGFBP-1. Pour le contrôle externe. |
| 20 Tubes d'extraction | Pour les spécimens de préparation à utiliser. |
| 1 Poste de travail | Place pour les flacons et tubes de tampon de maintien. |
| 1 Insert de package | Pour l'instruction de fonctionnement. |
Matériaux requis mais non fournis
| Minuteur | Pour une utilisation du timing. |
PRÉCAUTIONS
■ Pour une utilisation diagnostique in vitro professionnelle uniquement.
■ N'utilisez pas après la date d'expiration indiquée sur le package. N'utilisez pas le test si sa pochette en papier d'aluminium est endommagée. Ne réutilisez pas les tests.
■ Ce kit contient des produits d'origine animale. La connaissance certifiée de l'origine et / ou de l'état sanitaire des animaux ne garantit pas totalement l'absence d'agents pathogènes transmissibles. Il est donc recommandé que ces produits soient traités comme potentiellement infectieux et gérés par l'observation des précautions de sécurité habituelles (n'ingérez pas ou n'inhalez pas).
■ Évitez la contamination croisée des échantillons en utilisant un nouveau conteneur de collecte d'échantillons pour chaque échantillon obtenu.
■ Lisez attentivement l'intégralité de la procédure avant d'effectuer des tests.
■ Ne mangez pas, ne buvez pas, ne fumez pas dans la zone où les spécimens et les kits sont manipulés. Gérer tous les échantillons comme s'ils contenaient des agents infectieux. Observez les précautions établies contre les risques microbiologiques tout au long de la procédure et suivez les procédures standard pour l'élimination appropriée des échantillons. Portez des vêtements de protection tels que des manteaux de laboratoire, des gants jetables et une protection oculaire lorsque les échantillons sont testés.
■ N'échangez pas et n'échangez pas les réactifs de différents lots. Ne mélangez pas les bouchons de bouteilles de solution.
■ L'humidité et la température peuvent nuire aux résultats.
■ Lorsque la procédure de test est terminée, disposez soigneusement les écouvillons après les avoir automatiquement autoclacés à 121 ° C pendant au moins 20 minutes. Alternativement, ils peuvent être traités avec un hypochlorure de sodium à 0,5% (ou blanchi de maison) pendant une heure avant l'élimination. Les matériaux d'essai utilisés doivent être rejetés conformément aux réglementations locales, étatiques et / ou fédérales.
■ N'utilisez pas de pinceaux de cytologie avec des patients enceintes.
Stockage et stabilité
■ Le kit doit être stocké à 2-30 ° C jusqu'à imprimé la date d'expiration sur la pochet scellée.
■ Le test doit rester dans la pochette scellée jusqu'à l'utilisation.
■ Ne gèle pas.
■ Des soucis doivent être pris pour protéger les composants de ce kit contre la contamination. N'utilisez pas s'il existe des preuves de contamination microbienne ou de précipitations. La contamination biologique des équipements de distribution, des conteneurs ou des réactifs peut conduire à de faux résultats.
Collection et stockage des spécimens
Utilisez uniquement des écouvillons stériles à pointe de dacron ou de rayonne avec des arbres en plastique. Il est recommandé d'utiliser l'écouvillon fourni par le fabricant de kits (les écouvillons ne sont pas contenus dans ce kit, pour les informations de commande, veuillez contacter le fabricant ou le distributeur local, le numéro de catalcoge est 207000). Les écouvillons d'autres fournisseurs n'ont pas été validés. Les écouvillons avec des pointes de coton ou des arbres en bois ne sont pas recommandés.
■ Un échantillon est obtenu à l'aide d'un casse-tête en polyester stérile. L'échantillon doit être prélevé avant d'effectuer un examen numérique et / ou une échographie transvaginale. Veillez à ne rien toucher avec l'écouvillon avant de prendre l'échantillon. Insérez soigneusement la pointe de l'écouvillon dans le vagin vers le fornix postérieur jusqu'à ce que la résistance soit respectée. Alternativement, l'échantillon peut être prélevé sur le fornix postérieur lors d'un examen de spéculum stérile. L'évaluateur doit être laissé dans le vagin pendant 10 à 15 secondes pour lui permettre d'absorber la sécrétion vaginale. Tirez soigneusement l'écouvillon!.
■ Mettez l'écouvillon dans le tube d'extraction, si le test peut être exécuté immédiatement. Si les tests immédiats ne sont pas possibles, les échantillons de patients doivent être placés dans un tube de transport sec pour le stockage ou le transport. Les écouvillons peuvent être stockés pendant 24 heures à température ambiante (15-30 ° C) ou 1 semaine à 4 ° C ou pas plus de 6 mois à -20 ° C. Tous les échantillons doivent être autorisés à atteindre une température ambiante de 15-30 ° C avant les tests.
PROCÉDURE
Apportez des tests, des échantillons, du tampon et / ou des commandes à température ambiante (15-30 ° C) avant utilisation.
■ Placer un tube d'extraction propre dans la zone désignée du poste de travail. Ajouter 1 ml de tampon d'extraction dans le tube d'extraction.
■ Mettez l'écouvillon de l'échantillon dans le tube. Mélanger vigoureusement la solution en faisant tourner l'écouvillon avec force contre le côté du tube pendant au moins dix fois (tandis que submergé). Les meilleurs résultats sont obtenus lorsque l'échantillon est vigoureusement mélangé dans la solution.
■ Sortez autant de liquide que possible de l'écouvillon en pinçant le côté du tube d'extraction flexible lorsque l'écouvillon est retiré. Au moins 1/2 de la solution de tampon d'échantillon doit rester dans le tube pour une migration capillaire adéquate à se produire. Mettez le capuchon sur le tube extrait.
Jeter l'écouvillon dans un conteneur de déchets biohazard approprié.
■ Les échantillons extraits peuvent conserver à température ambiante pendant 60 minutes sans affecter le résultat du test.
■ Retirez le test de sa pochette scellée et placez-la sur une surface de niveau propre. Étiquetez l'appareil avec un patient ou un contrôle d'identification. Pour obtenir un meilleur résultat, le test doit être effectué dans un délai d'une heure.
■ Ajouter 3 gouttes (environ 100 µL) d'échantillon extrait du tube d'extraction au puits de l'échantillon sur la cassette d'essai.
Évitez de piéger les bulles d'air dans le (s) échantillon (s) et ne déposez aucune solution dans la fenêtre d'observation.
Alors que le test commence à fonctionner, vous verrez la couleur se déplacer à travers la membrane.
■ Attendez que le ou les groupes colorés apparaissent. Le résultat doit être lu à 5 minutes. N'interprétez pas le résultat après 5 minutes.
Jeter les tubes à essai utilisés et tester les cassettes dans un conteneur de déchets biohazard approprié.
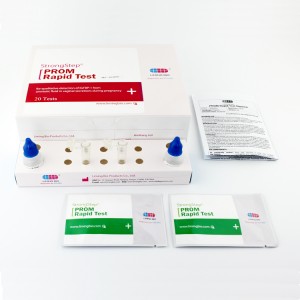
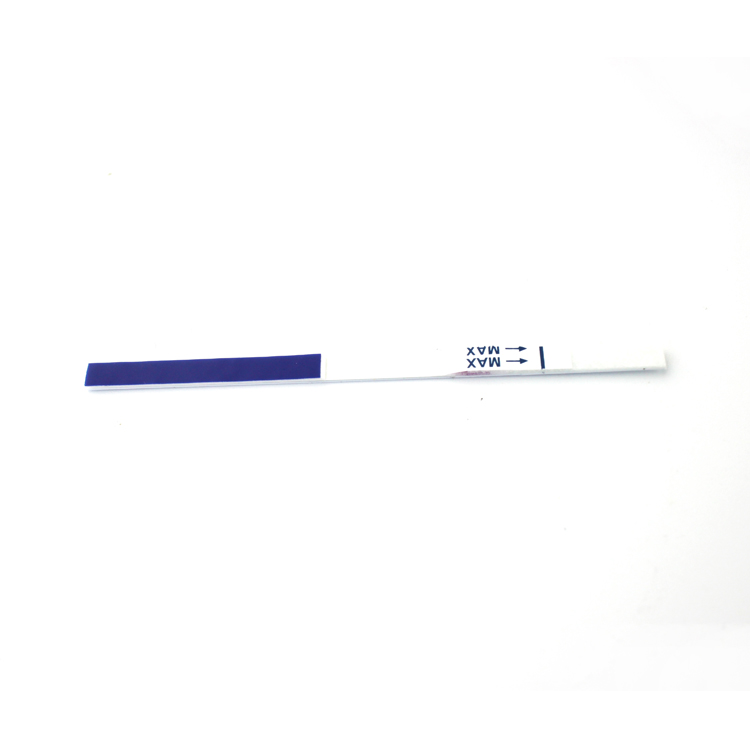
Interprétation des résultats
| POSITIFRÉSULTAT:
| Deux bandes colorées apparaissent sur la membrane. Une bande apparaît dans la région de contrôle (C) et une autre bande apparaît dans la région de test (T). |
| NÉGATIFRÉSULTAT:
| Une seule bande colorée apparaît dans la région de contrôle (C). Aucune bande colorée apparente n'apparaît dans la région de test (T). |
| INVALIDERÉSULTAT:
| La bande de contrôle ne parvient pas à apparaître. Les résultats de tout test qui n'ont produit aucune bande de contrôle au temps de lecture spécifié doivent être rejetés. Veuillez consulter la procédure et répéter avec un nouveau test. Si le problème persiste, interrompez l'utilisation du kit immédiatement et contactez votre distributeur local. |
NOTE:
1. L'intensité de la couleur dans la région d'essai (t) peut varier en fonction de la concentration des substances visées présentes dans l'échantillon. Mais le niveau de substances ne peut pas être déterminé par ce test qualitatif.
2.
CONTRÔLE DE QUALITÉ
■ Les contrôles de procédure interne sont inclus dans le test. Une bande colorée apparaissant dans la région de contrôle (c) est considérée comme un contrôle procédural positif interne. Il confirme un volume d'échantillons suffisant et une technique procédurale correcte.
■ Les contrôles procéduraux externes peuvent être fournis (sur demande uniquement) dans les kits pour s'assurer que les tests fonctionnent correctement. De plus, les commandes peuvent être utilisées pour démontrer les performances appropriées par l'opérateur de test. Pour effectuer un test de contrôle positif ou négatif, complétez les étapes de la section de procédure de test traitant l'écouvillon témoin de la même manière qu'un échantillonnage d'échantillon.
Limitations du test
1. Aucune interprétation quantitative ne doit être faite sur la base des résultats des tests.
2. N'utilisez pas le test si sa pochette d'aluminium en aluminium ou les joints de la poche ne sont pas intactes.
3.Un Strongstep positif®Le résultat du test du PROL, bien que détecter la présence de liquide amniotique dans l'échantillon, ne localise pas le site de la rupture.
4.Is avec tous les tests de diagnostic, les résultats doivent être interprétés à la lumière d'autres résultats cliniques.
5.Si la rupture des membranes fœtales s'est produite, mais la fuite du liquide amniotique a cessé plus de 12 heures avant la prise de l'échantillon, l'IGFBP-1 peut avoir été dégradé par les protéases dans le vagin et le test peut donner un résultat négatif.
Caractéristiques de performance
Tableau: fort®Test de bal contre un autre test de bal de marque
|
Sensibilité relative: |
| Une autre marque |
| ||
| + | - | Total | |||
| Pas fort®BAL DE PROMO Test | + | 63 | 3 | 66 | |
| - | 2 | 138 | 140 | ||
|
| 65 | 141 | 206 | ||
Sensibilité analytique
La quantité détectable la plus faible d'IGFBP-1 dans l'échantillon extrait est de 12,5 μg / L.
Substances interférentes
Il faut prendre soin de ne pas contaminer l'applicateur ou les sécrétions cervicovaginales avec des lubrifiants, des savons, des désinfectants ou des crèmes. Les lubrifiants ou les crèmes peuvent interférer physiquement avec l'absorption de l'échantillon sur l'applicateur. Les savons ou les désinfectants peuvent interférer avec la réaction anticorps-antigène.
Les substances interférentes potentielles ont été testées à des concentrations qui pourraient être raisonnablement trouvées dans les sécrétions cervicovaginales. Les substances suivantes n'ont pas interféré dans le test lorsqu'ils sont testés aux niveaux indiqués.
| Substance | Concentration | Substance | Concentration |
| Ampicilline | 1,47 mg / ml | Prostaglandine f2 | 0,033 mg / ml |
| Érythromycine | 0,272 mg / ml | Prostaglandine E2 | 0,033 mg / ml |
| Urine maternelle 3ème trimestre | 5% (vol) | Monistatr (miconazole) | 0,5 mg / ml |
| Pharmacie | 10 UI / ML | Carmin d'indigo | 0,232 mg / ml |
| Terbutaline | 3,59 mg / ml | Gentamicine | 0,849 mg / ml |
| Dexaméthasone | 2,50 mg / ml | Gel betadiner | 10 mg / ml |
| Mgso4•7h2o | 1,49 mg / ml | Nettoyant Betadiner | 10 mg / ml |
| Ritodrine | 0,33 mg / ml | K-YY Jelly | 62,5 mg / ml |
| Dermicidolr 2000 | 25,73 mg / ml |
Références de la littérature
Erdemoglu et Mungan T. Signification de la détection de la protéine de liaison au facteur de croissance de type insuline dans les sécrétions cervicovaginales: comparaison avec le test de nitrazine et l'évaluation du volume du liquide amniotique. Acta Obstet Gynecol Scand (2004) 83: 622-626.
Kubota t et Takeuchi H. Évaluation de la protéine de liaison du facteur de croissance de type insuline comme outil de diagnostic pour la rupture des membranes. J Obstet Gynecol Res (1998) 24: 411-417.
Rutanen Em et al. Évaluation d'un test de bande rapide pour la protéine de liaison du facteur de croissance de type insuline dans le diagnostic des membranes fœtales rompues. Clin Chim Acta (1996) 253: 91-101.
Rutanen EM, Pekonen F, Karkkainen T. Mesure de la protéine de liaison au facteur de croissance de type insuline dans les sécrétions cervicales / vaginales: comparaison avec l'immunodosage de la membrane ROM-Check dans le diagnostic des membranes fœtales rompues. Clin Chim Acta (1993) 214: 73-81.
Glossaire des symboles
|
| Numéro de catalogue |  | Limitation de température |
 | Consulter des instructions pour une utilisation |
| Code par lots |
 | Dispositif médical diagnostique in vitro |  | Utiliser par |
 | Fabricant |  | Contient suffisamment |
 | Ne réutilisez pas |  | Représentant autorisé dans la communauté européenne |
 | CE marqué selon la directive IVD Medical Devices 98/79 / EC | ||